STC 成首間香港實驗室 簽發入口澳門的中成藥報告
為符合不同巿場政府的中成藥進口及註冊條例,STC (香港標準及檢定中心) 不斷緊貼各地政府的要求,精益求精地更新檢測方法及考取認証資格,以幫助業界在各地發展業務,尤其新興的巿場—澳門進口中成藥產品,為中成藥業界迎來好消息!
STC 已成為本港首間可簽發具 CNAS 認証的「三安」測試報告,以現行《中華人民共和國藥典》(CP2020) 的方法檢測中成藥的重金屬、農藥及微生物限度,這正好切合澳門政府進口中成藥安全性報告及註冊的需求。根據澳門政府藥物監督管理局於 2022 年 3 月的公布,按第 23/ISAF/2022 號及第 20/ISAF/2022 號批示,要求中成藥進口商提供根據《中華人民共和國藥典》方法或其他現行藥典所載的方法,進行的「三安」具認可的報告。
批示概略如下:
|
具資質的檢驗機構 |
只接受已取得中國計量認証或中國合格評定國家認可委員會(CNAS) 認証及 ISO17025 相關檢驗資質的檢驗機構發出的樣品檢驗報告 |
|
報告內容 |
甲) 口服中成藥 (如丸劑、膠囊劑、顆粒劑、散劑等) ² 重金屬: 砷、鎘、鉛、汞 ² 9 種農藥殘留限量 (艾氏劑及狄氏劑、氯丹、滴滴涕、異狄氏劑、七氯、六氯苯、六六六、林丹、五氯硝基苯) ² 微生物限度 (按產品是否含有動物成分及原藥材為準則進行 3-5 項微生物測試) 乙) 外用中成藥 (如搽劑、軟膏劑等) ² 重金屬: 砷、銅、鉛、汞 ² 9 種農藥殘留限量 (艾氏劑及狄氏劑、氯丹、滴滴涕、異狄氏劑、七氯、六氯苯、六六六、林丹、五氯硝基苯) ² 微生物限度( 4 項微生物測試) |
|
測試方法 |
² 根據現行《中華人民共和國藥典》(CP2020)或其他現行藥典所載的方法進行 ² 微生物限度進行測試前,需為產品先進行微生物方法學驗證,以確認其測試方法的有效性 |
|
註冊要求 |
² 需提交最少三個最新批次的製成品「三安」檢驗報告 |
|
標準 |
² 重金屬及農藥 (參看表 1 及 2 ) ² 微生物限度—參照《中華人民共和國藥典》的限度標準 |
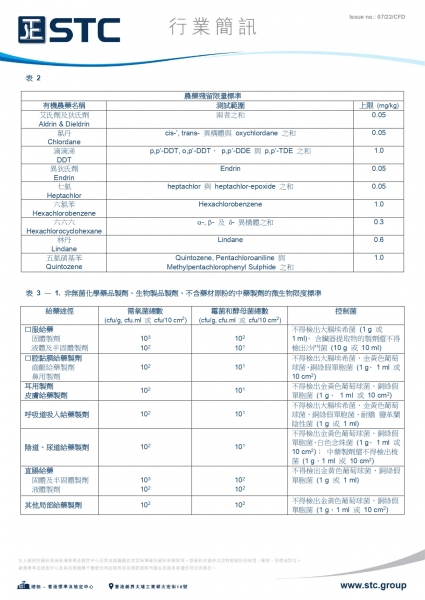
表 1 —「三安」標準
|
口服中成藥 |
|
外用中成藥 |
||
|
重金屬或有毒元素 |
上限(µg) |
|
重金屬或有毒元素 |
上限(mg/kg) |
|
砷 |
每日 1,500.00 |
|
砷 |
5.00 |
|
鎘 |
每日 3,500.00 |
|
銅 |
150.00 |
|
鉛 |
每日 179.00 |
|
鉛 |
20.00 |
|
汞 |
每日 36.00 |
|
汞 |
0.50 |
表 2
|
農藥殘留限量標準 |
||
|
有機農藥名稱 |
測試範圍 |
上限(mg/kg) |
|
艾氏劑及狄氏劑 Aldrin & Dieldrin |
兩者之和 |
0.05 |
|
氯丹 Chlordane |
cis-’, trans- 異構體與 oxychlordane 之和 |
0.05 |
|
滴滴涕 DDT |
p,p’-DDT, o,p’-DDT, p,p’-DDE 與 p,p’-TDE 之和 |
1.0 |
|
異狄氏劑 Endrin |
Endrin |
0.05 |
|
七氯 Heptachlor |
heptachlor 與 heptachlor-epoxide 之和 |
0.05 |
|
六氯苯 Hexachlorobenzene |
Hexachlorobenzene |
1.0 |
|
六六六 Hexachlorocyclohexane |
a-, b- 及d- 異構體之和 |
0.3 |
|
林丹 Lindane |
Lindane |
0.6 |
|
五氯硝基苯 Quintozene |
Quintozene, Pentachloroaniline 與 Methylpentachlorophenyl Sulphide 之和 |
1.0 |
表 3 — 1. 非無菌化學藥品製劑、生物製品製劑、不含藥材原粉的中藥製劑的微生物限度標準
|
給藥途徑 |
需氧菌總數 (cfu/g, cfu.ml 或 cfu/10 cm2) |
霉菌和酵母菌總數 (cfu/g, cfu.ml 或 cfu/10 cm2) |
控制菌 |
|
口服給藥 固體製劑 液體及半固體製劑 |
103
102 |
102
101 |
不得檢出大腸埃希菌 (1 g 或 1 ml),含臟器提取物的製劑還不得檢出沙門菌 (10 g 或 10 ml) |
|
口腔黏膜給藥製劑 齒齦給藥製劑 鼻用製劑 |
102
|
101
|
不得檢出大腸埃希菌、金黃色葡萄球菌、銅綠假單胞菌 (1 g、 1 ml 或 10 cm2) |
|
耳用製劑 皮膚給藥製劑 |
102
|
101
|
不得檢出金黃色葡萄球菌、銅綠假單胞菌 (1 g、 1 ml 或 10 cm2) |
|
呼吸道吸入給藥製劑 |
102
|
101
|
不得檢出大腸埃希菌、金黃色葡萄球菌、銅綠假單胞菌、耐膽鹽革蘭陰性菌 (1 g 或 1 ml) |
|
陰道、尿道給藥製劑 |
102
|
101
|
不得檢出金黃色葡萄球菌、銅綠假單胞菌、白色念珠菌 (1 g、 1 ml 或 10 cm2);
中藥製劑還不得檢出梭菌 (1 g、1 ml 或 10 cm2) |
|
直腸給藥 固體及半固體製劑 液體製劑 |
103
102 |
102
102 |
不得檢出金黃色葡萄球菌、銅綠假單胞菌 (1 g 或 1 ml) |
|
其他局部給藥製劑 |
102
|
102
|
不得檢出金黃色葡萄球菌、銅綠假單胞菌 (1 g、1 ml 或 10 cm2) |
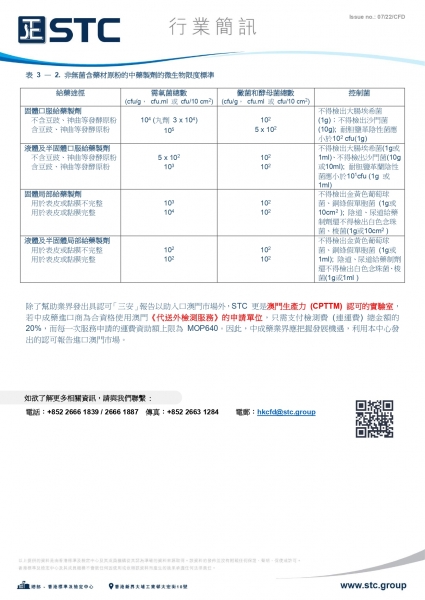
表 3 — 2. 非無菌含藥材原粉的中藥製劑的微生物限度標準
|
給藥途徑 |
需氧菌總數 (cfu/g, cfu.ml 或 cfu/10 cm2) |
黴菌和酵母菌總數 (cfu/g, cfu.ml 或 cfu/10 cm2) |
控制菌 |
|
固體口服給藥製劑 不含豆豉、神曲等發酵原粉 含豆豉、神曲等發酵原粉 |
104 (丸劑 3 x 104)
105 |
102
5 x 102 |
不得檢出大腸埃希菌 (1 g);不得檢出沙門菌 (10 g);
耐胆鹽革陰性菌應小於102 cfu(1 g) |
|
液體及半固體口服給藥製劑不含豆豉、神曲等發酵原粉 含豆豉、神曲等發酵原粉 |
5 x 102
103 |
102
102 |
不得檢出大腸埃希菌(1 g 或1 ml)、不得檢出沙門菌(10 g 或10 ml);
耐胆鹽革蘭陰性菌應小於101cfu (1 g 或 1 ml) |
|
固體局部給藥製劑 用於表皮或黏膜不完整 用於表皮或黏膜完整 |
103
104 |
102
102 |
不得檢出金黃色葡萄球菌、銅綠假單胞菌 (1 g或10 cm2 );
陰道、尿道給藥制劑還不得檢出白色念珠菌、梭菌(1 g或 10 cm2 ) |
|
液體及半固體局部給藥製劑 用於表皮或黏膜不完整 用於表皮或黏膜完整 |
102
102 |
102
102 |
不得檢出金黃色葡萄球菌、銅綠假單胞菌 (1 g 或 1 ml);
陰道、尿道給藥制劑還不得檢出白色念珠菌、梭菌(1 g或1 ml ) |
除了幫助業界發出具認可「三安」報告以助入口澳門巿場外,STC 更是澳門生產力 (CPTTM) 認可的實驗室,若中成藥進口商為合資格使用澳門《代送外檢測服務》的申請單位,只需支付檢測費 (連運費) 總金額的 20%,而每一次服務申請的運費資助額上限為 MOP640。因此,中成藥業界應把握發展機遇,利用本中心發出的認可報告進口澳門巿場。
如欲查詢有關詳情,請聯絡我們。